2023-10-01 阅读(516)
免疫沉淀 (IP) 是指从细胞/组织/血液混合物中富集纯化其特异性的靶标或抗原。
免疫共沉淀( CoIP ) 指用抗体用于从混合样品中富集纯化其靶抗原及其结合蛋白。在这种情况下,抗原是诱饵蛋白,而其结合蛋白是通过抗体--抗原相互作用共同纯化的相互作用的蛋白。
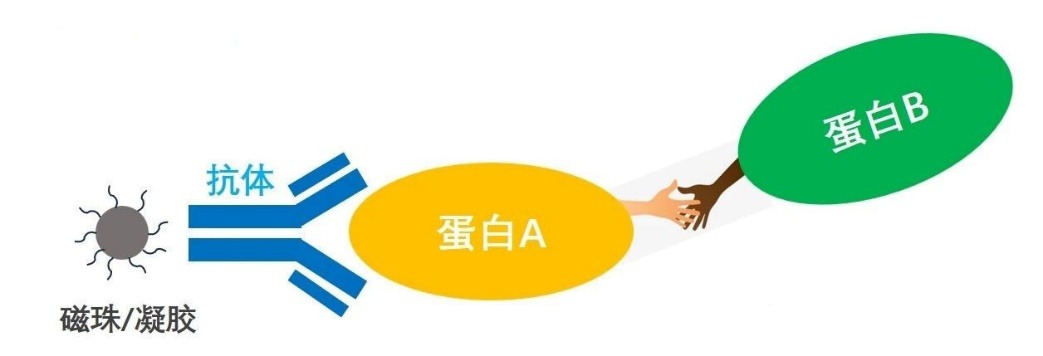
(1)测定两种甚至更多种蛋白质是否在体内结合;
(2)鉴定一种特定蛋白质的作用搭档;
(3)分离得到天然状态的相互作用蛋白复合物。
因此,如何简洁并有效的设置分组来明确蛋白间是否互作是CO-IP实验的关键因素之一。
一个成功的Co-IP实验,首先得证明靶蛋白A和预测的相互作用的蛋白B存在于蛋白质样品中,所以抽出来的蛋白样品要直接检测一下A和B的存在,这个一般称为Input。
然后要证明IP抗体是不是能捕获靶蛋白,所以做完IP后要检测一下靶蛋白。我们需要注意,western的一抗未必能作为IP抗体去捕获靶蛋白,因为western检测时,蛋白是变性的状态,空间结构都打开了。很多抗体在制备时使用的是合成的肽段作为抗原,这样的抗体不一定能识别非变性状态下折叠起来的目的蛋白。所以选IP抗体时一定要注意抗体的介绍上提到的应用(类似 ChIP, Flow Cyt, ICC/IF, IHC-P, IP, WB等),而且即使购买的抗体说明书标记可以用于IP实验,其在不同样品中的效果还是需要实际检测效果。

如果靶蛋白A没有检测到,那么可能有如下几种原因:
要么IP抗体有问题,这个就要换不同的抗体试了,要么beads没有结合上抗体,这种情况可以通过WB来检测。一般常用的抗体大部分是鼠源或者兔源,WB时候通过重链/轻链即可判定beads是否偶联上抗体。也有可能是蛋白A表达水平过低,这种情况可以加大样品量。
如果内源性Co-IP,Input也没有检测出来,这种情况可能是样品本身靶蛋白含量太低或者蛋白提取没有做好,当然,抗体原因也不容忽视。所以我们一般情况可以先尝试做过表达的Co-IP。
IP后A、B蛋白都能检测到,固然是值得高兴的,但是这结果是不是假阳性呢?还得做个阴性对照,目前文献中常提到有几种方法:
(1)只加入beads不加入IP抗体
(2)加入一种不相干的蛋白的抗体作为IP抗体
(3)加入正常IgG作为IP抗体
(4)使用不表达靶蛋白A但表达B的蛋白样品做对照。
另外,CO-IP一般分为内源性和外源性,我们可以简单理解为内源性CO-IP是检测细胞本身含有的蛋白A和蛋白B互作有无;外源性CO-IP是将蛋白A和蛋白B在细胞内过表达后,再检测二者互作有无。
对于内源性Co-IP实验,如果出现阴性结果,也有可能是蛋白在细胞内表达过低导致,这种情况也可以先做过表达Co-IP作为对照。
只有设置了正确的对照,出来的结果才是可以被合理解释的,也是被认可的。
IB:即immunoblotting(免疫印迹)也就是常规的Western Blotting,用于检测目的蛋白。
IP:即immunoprecipitation(免疫沉淀)这一步主要是为了纯化富集目的蛋白。
Input:全细胞裂解液,可认为是阳性组。也就是处理完样本得到的细胞样品,在做IP实验之前,需要预留Input,在检测IP的结果同时确认样本中含有蛋白A和蛋白B。
Anti-A:A蛋白的免疫共沉淀抗体
IgG:Anti-A的同型对照抗体,即跟Anti-A同种属来源,如Anti-A是鼠源IgG型,则同型对照抗体需要选择Mouse IgG
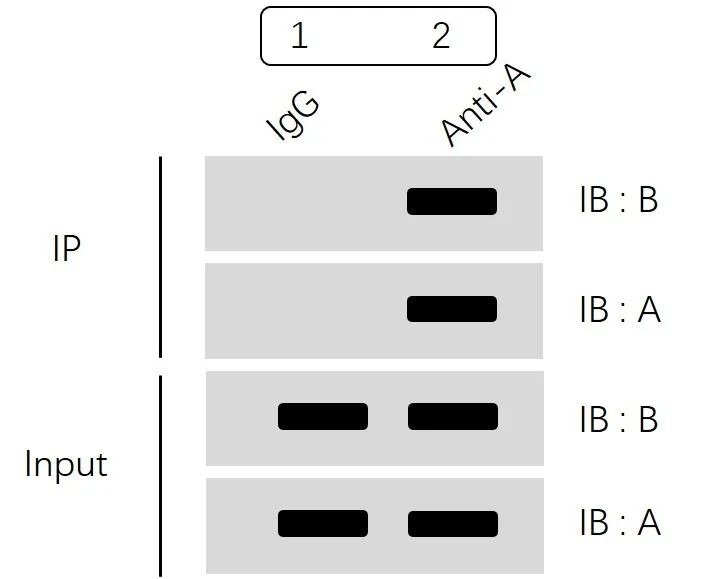
上面示意图分为两大部分:IP部分和Input部分。
首先看Input部分,通过分别检测蛋白A和蛋白B表达水平,我们可以确认:
1组(IgG组)和2组(Anti-A组)中蛋白A、蛋白B均有表达,并且表达量一致,排除了因部分组别部分蛋白表达缺失、不同组蛋白表达量差异化大等原因造成的假阴性或者假阳性。
然后我们再看IP部分:
“IB:A”结果显示我们1组(IgG组)不结合蛋白A,2组(Anti-A组)可以特异性富集蛋白A。
“IB:B”结果显示我们IgG组没有非特异性结合,Anti-A组通过特异性富集蛋白A进而拉下蛋白B,即提示我们蛋白A和蛋白B可形成复合物,存在互作。
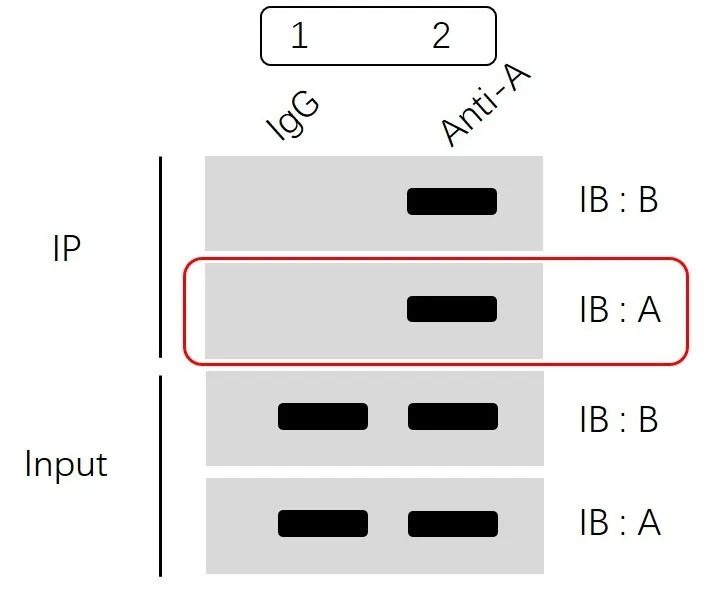
IP部分的“IB:A”这一步检测很关键,可以明确的告诉我们蛋白A已经被我们通过免疫沉淀方法成功的特异性识别并富集到了磁珠/凝胶上,也就是说免疫沉淀的实验操作已成功。而下一步能否检测到蛋白B,主要是由两者是否存在互作决定的,当然,蛋白表达量低,需要某种刺激条件等因素也会影响蛋白B能否被检测到。
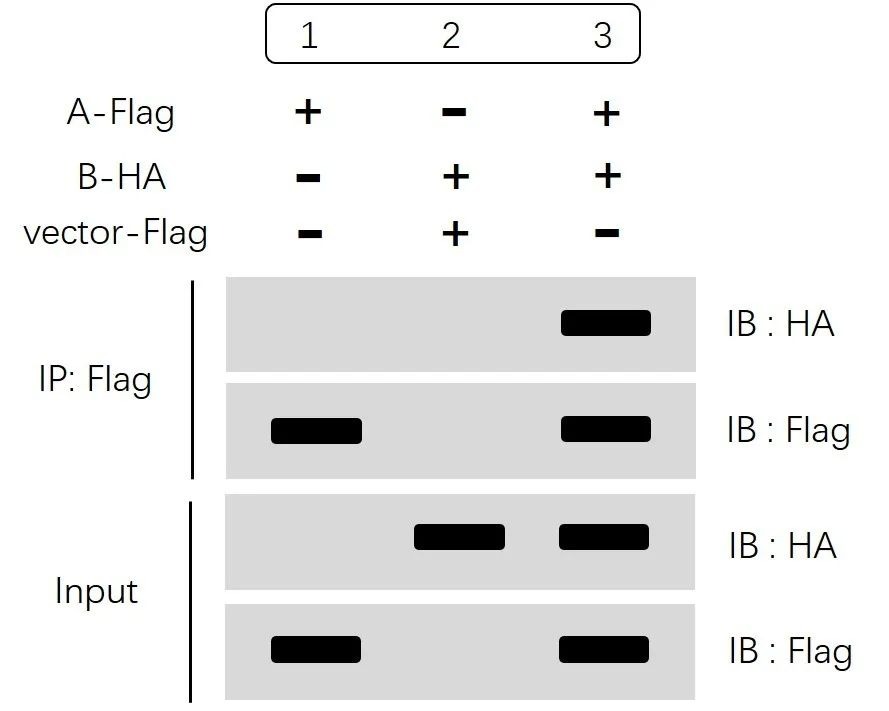
上图结果同样分为两大部分:IP部分和Input部分。外源性一般我们不需要设置IgG组(阴性对照),可以利用空载等方式设置阴性对照组。
首先看Input 部分,通过分别检测HA和Flag表达水平,我们可以确认:
A-Flag和B-HA过表达后都能被检测到,并且表达量一致,排除了因样品量不均匀、样品组分缺失等原因造成的假阴性或者假阳性。
然后我们再看IP部分,“IB:Flag”结果显示1、3组通过IP:Flag可以特异性识别Flag标签并富集蛋白A。“IB:HA”结果显示1、2对照两组没有捕获蛋白B,第3组通过特异性富集蛋白A进而捕获蛋白B,即提示我们蛋白A和蛋白B可形成复合物,存在互作。
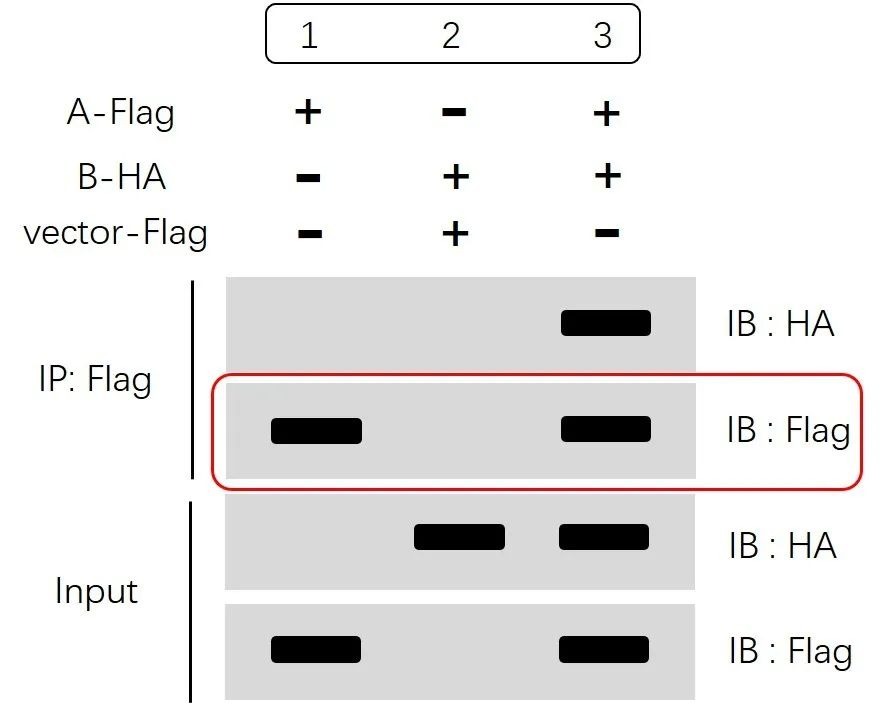
“IP:Flag IB:Flag”这一步也是为了明确免疫沉淀特异性识别并利用磁珠/凝胶富集蛋白A的实验过程是成功的。
当然我们也有小伙伴选择以下分组方式
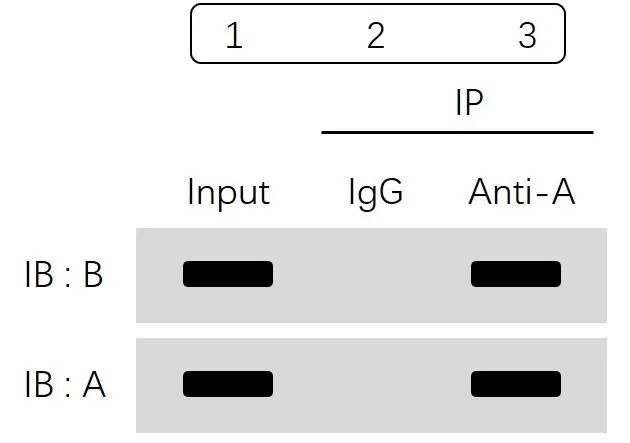
本实验一共分为两大组:Input部分及IP部分。
其中IP组又分为IgG组(阴性对照组)和实验组,并通过WB去验证蛋白A和B在每一个组里面是否存在。
由Input组得到结论:蛋白A与蛋白B都是存在的,证明样本处理提取蛋白的步骤没有任何问题。这也提示:本实验一般是选取同一份细胞样品,提前取出部分做Input,其余均分为两份即IgG组(阴性对照组)和实验组。
我们继续看IP部分:2组(IgG组)结果显示,蛋白A与蛋白B均没有条带,说明利用IgG抗体没有把蛋白A和B沉淀下来,证明蛋白A和B与IgG没有结合,同时排除了蛋白与抗体非特异性结合的可能性;而实验组蛋白A和B均有条带,表示利用蛋白A的抗体进行免疫沉淀,富集了蛋白A,同时蛋白B也被拉下来,即提示我们蛋白A和蛋白B可形成复合物,存在互作。
以上只是我们举了几个比较常用的例子,设置不同对照组的最终目的就是为了让实验组简洁有效的得出确定的结果。所以各位小伙伴可以根据自己实际情况选择最优方案。